Yasal Uyarı
Bu site, ALS hastalığı ile ilgili haber ve bilgilendirme sitesidir. Tıbbi tavsiye, teşhis veya tedavi yerine geçmez. Tıbbi bir durumla ilgili sorularınız için her zaman doktorunuzla görüşün.
Dr. Alper Kaya
30 Mart 2015 Pazartesi
12 v DC ile solunum cihazı çalıştırmak
Solunum cihazları genellikle 12 v DC akü desteği ile çalışacak şekilde üretilir. Bazı markalar solunum cihazını içerisinde doldurulabilir aküsü ile veriyor. Bu tip akülü solunum cihazı elektrik kesintisi sırasında genellikle 2 saat idare ediyor. Ayrıca bütün solunum cihazları 12 v dc araba çakmak adaptörü ile kullanılabilir. Ancak her marka model kendisine has adaptör ile kullanılıyor.
Ayrıca akülü tekerlekli sandalyeden solunum cihazı için 12 v çakmak soketi yardımı ile elektrik alınabilir. Yurtdışında akülü tekerlekli sandalyelerde bu tür soketler standarttır.
Akülü tekerlekli sandalyeler genellikle 24 v DC ile çalışır. 2-4 adet 12 v aküden 24 v elektrik alınır. Değişik amperlerde 12 v aküler mevcuttur. Amper yükseldikçe daha uzun süreli güç desteği verir.
Akülü tekerlekli sandalye akü bölmesinin kapaklarını açtığınızda 12 v dc kutup başından çakmak soketine oto elektrik kablosu ile elektrik alınabilir. Örneğin 2 adet 12 v 18 amper aküyü paralel bağlayarak 12 v - 18 amper güç elde edilebilir.
Kendi akülü tekerlekli sandalyemde 12 v 18 amper çakmak soketi takdırdım. Şarj dolu iken solunum cihazımı kesintisiz 8 saat çalıştırıyor.
Elektrik kesintisi için akülü sandalye çakmak adaptörü, diğer 220 v UPS güç kaynağına oranla ucuz çözüm olabilir.
Ventilator 12 V DC girişi yoksa invertör kullanabilirsiniz. 12 V DC > 200 V AC dönüştüren invertör için en az 600 watt gücünde olmalı ve en az 12 V 40 amper akü ile kullanılması tavsiye ediliyor. Arabada çakmaktan çalışan invertör ile 220 v Solunum cihazı ve aspiratör çalışır. Yolculuk için uygun bir çözüm.
Türkiye’de Akülü sandalyeye Ventilator bağlamak için orjinal Ventilatör aparatı bulmak zor. Ben kafesli küçük market sepetinden bozma Ventilator sepeti yaptırdım.
17 Mart 2015 Salı
GM604 hakkında
Amerikan ilaç şirketi Genervon tarafından üretilen GM6 veya GM604 denilen bir ilaç son zamanlarda sosyal medyada bir dilekçe kampanyasının konusu olmuştur.
https://www.change.org/p/lisa-murkowski-fda-accelerated-approval-of-genervon-s-gm604-for-use-in-als
En son basın duyurusu
Avrupa Birliği GM604 için yetim ilaç kararı aldı.
GM604 nedir?
Genervon firmasının GM604 molekülü embriyonik gelişim içinde 'ana regülatör' gibi çalışan küçük bir peptid'dir. (bir peptit biyolojik yapı taşıdır) Yetişkin motor nöronlar embriyonik olanlardan çok farklı olmasına rağmen ALS tedavisinde Gm6 kullanım için mantıklı bir gerekçe var. Mevcut çok sınırlı bilgilerden, peptidin nörotrofik faktör gibi çalıştığı görünüyor. Nörotrofik faktörler sinir sisteminin gelişiminde önemli bir rol oynar ve ALS için tedavi potansiyeli olan birçok çalışmaya konu olmuştur. Nörodejeneratif hastalıkların fare modellerinde nöronları canlı tutmak çok önemlidir. Ama ne yazık ki (örneğin IGF-1, CNTF ve BDNF için) insanlarda büyük ölçekli klinik çalışmalarda gösterilebilecek kadar etkili olmamıştır.
Şu anda, Gm604 hakkında fazla bilgimiz yok. Kısa vadeli çalışmalar ilacın güvenli gibi görünen gerçeği ötesinde bize çok az bilgi veriyor. Genervon son zamanlarda GM604 için 'hızlandırılmış onay' kazanma olasılığını görüşmek üzere Gıda ve İlaç İdaresi (FDA) ile bir araya geldi. Toplantı Şubat ayında gerçekleşti ve FDA'nın kararı henüz ilan edilmemiştir.
Kişisel yorum: Gm604 piyasaya çıkacak en yakın aday. Kişisel görüşüm, burada ilacın etkinliğini henüz bilmiyoruz. Mucize bir etki beklemiyorum. Fakat daha önemlisi, dünyada ilk kez sivil hareket (change imza kampanyası) ile FDA ve Washington üzerinde baskı yaratılıyor. FDA kriterlerine çok bağlıdır. Bir kez taviz verirlerse arkası gelecektir. Etik konusu da cabası. Öte yandan Washington, kamu baskısına duyarsız kalamaz. Akıllı bir taktik bekleniyor. Bu konu bugün Alliance board meeting gündemindeydi.
http://www.genervon.com/genervon/about_pressreleases.php
Genervon firmasının ALS hastalarını kışkırtması da gözardı edilmemelidir. Ne de olsa firma ticaret yapmak istiyor. FDA accelerated approval verirse ilaç klinik FAZIII ile aynı zamanda sosyal güvence kapsamına girecek ve ABD de piyasada satılacak. ABD de 40000 ALS- hastası var;)
3 nisan tarihinde Abd'nin saygın gazetelerinden Washington post'un internet sitesinde Als ve yeni ilaç Gm604 ile alakalı yayınlanmış bir röpörtajın Türkçesini buraya koyuyorum. Hiçbir yorum yapmadım ve röpörtajın çok önemli olan bölümlerini çevirdim.
Henüz tedavisi olmayan Als hastalığı için geçtiğimiz sonbahar aylarında gelen bir haber, Als hastaları için umut ışığı oldu. Kaliforniya'lı küçük ilaç şirketi Genervon, Als hastalığına karşı geliştirdiği ilaçta, sonuçların sağlam, umut verici ve istatiksel olarak anlamlı olduğunu kamuoyuna duyurdu. Küçük ve erken aşamadaki bir denemeye göre oldukça coşkulu bir sonuç elde ettiğini söyleyen Genervon şirketi, Fda'ya başvurarak faz aşamalarını atlayıp, direkt piyasaya girmek için izin istedi. Bundan sonra ise internet üzerinden imza kampanyaları başlatıldı ve 500.000 imzanın üzerine çıkıldı.
Washington'da biraraya gelerek senato önünde açıklama yapan Als hastaları, Fda'nın bir an önce bu ilaca izin vermesi gerektiğini söyledi.Bazı araştırmacı ve bilimadamları ise 12 hafta boyunca 12 hastanın üzerinde denenen ilacın, piyasaya çıkmasının oldukça riskli olduğunu belirttiler. Als hastaları için zaten hızlı bir şekilde ölüme gittiklerini ve bu riski almak istediklerini belirtiyorlar. Eski Fda yöneticisi ve farmakolog olan David Gortler ise bilimin zaman aldığını, iyi bilimin zamana ihtiyacı olduğunu söyleyerek, hızlandırılmış onaya karşı çıktığını söyledi.
Als Terapi Geliştirme Enstitüsü başkanı Steve Perrin; ilaç ile alakalı iyileştirdiğine dair çok açık bilgilerin olmadığını söyledi. Columbia Üniversitesi de 115 milyon doların geçen sene ice bucket challange ile toplandığını belirtti ve Als’ye ilaç konusunda canla başla çalıştıklarını belirtti. Gm604 adlı ilacın ise üzerinde fazla çalışmadan yan etkilere sebep olabileceğini belirtti.
Genervon şirketi sahibi ise ilaç hakkında yaptığı açıklamada araştırmalarının yeterli ve ortaya çıkan sonucun ise olumlu ve pozitif olduğunu belirtti. Sözlerine devam eden Genervon ceosu Winston Ko, ilacın sonuçlarından emin olduklarını, ortaya çıkan verilerin iyi olduğunu belirterek, böyle olmasa neden izin almak için bu kadar çabalayalım ki, neden risk alıp insanları kandıralım ki, dedi.
Fda daha önce 2014 yılında birkaç ilaca, hızlı izin verdi. Ancak Fda bu konu hakkında yorum yapılmasını istemiyor ve hızlandırılmış onaya karşı gözüküyor. Genervon firması ısrarla ilacın işe yaradığını söylerken, klinik ve araştırmacılar ise ortada bir kanıtın olmadığını söylemekte ısrar ediyorlar. Genervon firması ilacın test edildiğini ve iki grup üstünde denendiğini söyledi. Als hastaları ve Placebo grubu. 6 doz ilaç verilen hastalarda olumlu gelişmeler gözle görülür şekilde ortaya çıktı. Ancak neredeyse tüm klinikler ve üniversiteler bunun yeterli olmadığını, çünkü 12 hasta, 6 doz ve birkaç haftanın, ilaç için yetersiz olduklarını söylüyorlar.
(Çeviri için Oguzhan Demir arkadaşıma teşekkür ederim)
https://www.change.org/p/lisa-murkowski-fda-accelerated-approval-of-genervon-s-gm604-for-use-in-als
En son basın duyurusu
Avrupa Birliği GM604 için yetim ilaç kararı aldı.
GM604 nedir?
Genervon firmasının GM604 molekülü embriyonik gelişim içinde 'ana regülatör' gibi çalışan küçük bir peptid'dir. (bir peptit biyolojik yapı taşıdır) Yetişkin motor nöronlar embriyonik olanlardan çok farklı olmasına rağmen ALS tedavisinde Gm6 kullanım için mantıklı bir gerekçe var. Mevcut çok sınırlı bilgilerden, peptidin nörotrofik faktör gibi çalıştığı görünüyor. Nörotrofik faktörler sinir sisteminin gelişiminde önemli bir rol oynar ve ALS için tedavi potansiyeli olan birçok çalışmaya konu olmuştur. Nörodejeneratif hastalıkların fare modellerinde nöronları canlı tutmak çok önemlidir. Ama ne yazık ki (örneğin IGF-1, CNTF ve BDNF için) insanlarda büyük ölçekli klinik çalışmalarda gösterilebilecek kadar etkili olmamıştır.
Şu anda, Gm604 hakkında fazla bilgimiz yok. Kısa vadeli çalışmalar ilacın güvenli gibi görünen gerçeği ötesinde bize çok az bilgi veriyor. Genervon son zamanlarda GM604 için 'hızlandırılmış onay' kazanma olasılığını görüşmek üzere Gıda ve İlaç İdaresi (FDA) ile bir araya geldi. Toplantı Şubat ayında gerçekleşti ve FDA'nın kararı henüz ilan edilmemiştir.
Kişisel yorum: Gm604 piyasaya çıkacak en yakın aday. Kişisel görüşüm, burada ilacın etkinliğini henüz bilmiyoruz. Mucize bir etki beklemiyorum. Fakat daha önemlisi, dünyada ilk kez sivil hareket (change imza kampanyası) ile FDA ve Washington üzerinde baskı yaratılıyor. FDA kriterlerine çok bağlıdır. Bir kez taviz verirlerse arkası gelecektir. Etik konusu da cabası. Öte yandan Washington, kamu baskısına duyarsız kalamaz. Akıllı bir taktik bekleniyor. Bu konu bugün Alliance board meeting gündemindeydi.
http://www.genervon.com/genervon/about_pressreleases.php
Genervon firmasının ALS hastalarını kışkırtması da gözardı edilmemelidir. Ne de olsa firma ticaret yapmak istiyor. FDA accelerated approval verirse ilaç klinik FAZIII ile aynı zamanda sosyal güvence kapsamına girecek ve ABD de piyasada satılacak. ABD de 40000 ALS- hastası var;)
3 nisan tarihinde Abd'nin saygın gazetelerinden Washington post'un internet sitesinde Als ve yeni ilaç Gm604 ile alakalı yayınlanmış bir röpörtajın Türkçesini buraya koyuyorum. Hiçbir yorum yapmadım ve röpörtajın çok önemli olan bölümlerini çevirdim.
Henüz tedavisi olmayan Als hastalığı için geçtiğimiz sonbahar aylarında gelen bir haber, Als hastaları için umut ışığı oldu. Kaliforniya'lı küçük ilaç şirketi Genervon, Als hastalığına karşı geliştirdiği ilaçta, sonuçların sağlam, umut verici ve istatiksel olarak anlamlı olduğunu kamuoyuna duyurdu. Küçük ve erken aşamadaki bir denemeye göre oldukça coşkulu bir sonuç elde ettiğini söyleyen Genervon şirketi, Fda'ya başvurarak faz aşamalarını atlayıp, direkt piyasaya girmek için izin istedi. Bundan sonra ise internet üzerinden imza kampanyaları başlatıldı ve 500.000 imzanın üzerine çıkıldı.
Washington'da biraraya gelerek senato önünde açıklama yapan Als hastaları, Fda'nın bir an önce bu ilaca izin vermesi gerektiğini söyledi.Bazı araştırmacı ve bilimadamları ise 12 hafta boyunca 12 hastanın üzerinde denenen ilacın, piyasaya çıkmasının oldukça riskli olduğunu belirttiler. Als hastaları için zaten hızlı bir şekilde ölüme gittiklerini ve bu riski almak istediklerini belirtiyorlar. Eski Fda yöneticisi ve farmakolog olan David Gortler ise bilimin zaman aldığını, iyi bilimin zamana ihtiyacı olduğunu söyleyerek, hızlandırılmış onaya karşı çıktığını söyledi.
Als Terapi Geliştirme Enstitüsü başkanı Steve Perrin; ilaç ile alakalı iyileştirdiğine dair çok açık bilgilerin olmadığını söyledi. Columbia Üniversitesi de 115 milyon doların geçen sene ice bucket challange ile toplandığını belirtti ve Als’ye ilaç konusunda canla başla çalıştıklarını belirtti. Gm604 adlı ilacın ise üzerinde fazla çalışmadan yan etkilere sebep olabileceğini belirtti.
Genervon şirketi sahibi ise ilaç hakkında yaptığı açıklamada araştırmalarının yeterli ve ortaya çıkan sonucun ise olumlu ve pozitif olduğunu belirtti. Sözlerine devam eden Genervon ceosu Winston Ko, ilacın sonuçlarından emin olduklarını, ortaya çıkan verilerin iyi olduğunu belirterek, böyle olmasa neden izin almak için bu kadar çabalayalım ki, neden risk alıp insanları kandıralım ki, dedi.
Fda daha önce 2014 yılında birkaç ilaca, hızlı izin verdi. Ancak Fda bu konu hakkında yorum yapılmasını istemiyor ve hızlandırılmış onaya karşı gözüküyor. Genervon firması ısrarla ilacın işe yaradığını söylerken, klinik ve araştırmacılar ise ortada bir kanıtın olmadığını söylemekte ısrar ediyorlar. Genervon firması ilacın test edildiğini ve iki grup üstünde denendiğini söyledi. Als hastaları ve Placebo grubu. 6 doz ilaç verilen hastalarda olumlu gelişmeler gözle görülür şekilde ortaya çıktı. Ancak neredeyse tüm klinikler ve üniversiteler bunun yeterli olmadığını, çünkü 12 hasta, 6 doz ve birkaç haftanın, ilaç için yetersiz olduklarını söylüyorlar.
(Çeviri için Oguzhan Demir arkadaşıma teşekkür ederim)
16 Mart 2015 Pazartesi
AKRABA EVLİLİĞİ VE GENETİK HASTALIKLAR
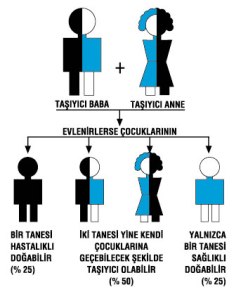
Binlerce genetik (kalıtımsal) hastalık var. Bu hastalıklara yol açan genlerin kaynağı ana, babalardır. Milyonlarca insan hastalık yaratan genler taşıyor. Organizma, organlardan, dokulardan onlar da milyarlarca hücrelerden oluşuyor. Hücrelerin nüvelerinde 25 bin kadar gen var. Genler DNA’dan oluşuyor, ve hücredeki 23 çift kromozom onlara taşıyıcı rol oynuyor. Çocuk anne ve babadan kromozom çiftlerinden birini alıyor. 23 çift kromozomdan bir tanesi (bir çift) cinsiyeti tayin ediyor ve bunlar X ve Y olarak anılıyor.
Hayata biri anneden biri babadan iki hücre ile başlıyoruz Sperm ve ovum. Çocuk birbirinin kopyası çift genlerden birini anneden birini babadan alıyor. Bu iki hücre bu genlerin olağanüstü marifeti ile bölünerek çoğalarak, beyinli karaciğerli miğdeli, böbrekli koca koca kadınları erkekleri oluşturuyorlar. Genler kader gibi, çevre mi genetik yapı mı tartışmalarına sık sık tanık oluyoruz.
Kaçınılmaz bir şekilde biraz karışık bu temel bilgilerden sonra genetik hastalıkların nasıl oluştuğunu ve akraba evliliğinin bu hastalıkları nasıl yarattığını konuşabiliriz. Hastalıkların kaynağı ana ve babalar dedik Bu kaynak bazen anne, bazen baba, bazen her ikisi birden oluyor. Kalıtım başlıca 3 şekilde oluyor. Birisi dominant (başat) geçiş adını alıyor. Yani anne, ya da baba hastalık genini taşıyor ve onun yol açtığı hastalıkla yaşıyor, bu durumda doğacak çocuk % 50 olasılıkla bu hastalığı alacaktır..%50 çünkü çift genlerden bir tanesi kusurlu, bir tanesi değil. Hangi çocuk kusurlu geni alırsa o hasta olacaktır. Ötekini alan çocuk hasta olmuyor.Hasta çocuk ilerde evlenip çocuk yaparsa tıpkı baba (veya anne) sı gibi % 50 olasılıkla hasta çocuk sahibi olacaktır.
İkinci kalıtım şekli cinsiyet kromozomu aracılığı ile olan.(X linked)
Bu hastalıklar kusurlu geni X kromozomunda taşıyan annelerden erkek çocuğa geçiyor. Anne hasta değil, taşıyıcı rol oynuyor. Kadınlarda XX iki X var. Bir tanesi hastalık nedeni olan geni taşıyor ama ikinci X koruyucu rol oynuyor. Erkek ise XY sahibi. Y’nin böyle bir koruyuculuk yeteneği yok (şu X , Y farkını ve kadın üstünlüğünü görüyor musunuz?). O nedenle erkek çocuk anneden X yolu ile hastalık genini alırsa hasta oluyor. Kız çocuğu bu ayni X’ i alınca hasta olmuyor, annesi gibi taşıyıcı oluyor. Çok sayıda sadece erkek çocuklarda görülen X e bağlı hastalık var. DMD Duchenne Müsküler Distrofi ve hemofili bunlardan ikisi.
Şimdi akraba evliliğine geliyoruz. Üçüncü kalıtım şekli resesiv (recessive) çekinik şekil.
Burada anne de baba da sağlıklı, çocuk hasta oluyor. Niçin? Anne ve baba birer tane hatalı gen taşıyorlar.Tek gen hastalık yaratmaya yetmiyor. Böyle bir çiftten hangi çocuk iki kusurlu geni alırsa o hasta oluyor. Genler çift olduğu için anne baba birleşmesinde 4 olasılık var. Annede ve babada çift genden bir tanesi kusurlu. Sağlam olanı alan çocuklar sağlam oluyor. İki değil bir tek kusurlu gen alan çocuk da tıpkı anne babası gibi hasta olmuyor ama taşıyıcı oluyor. İşte akraba evliliğinin riski burada ortaya çıkıyor. Akraba çocuklarının ayni cins genleri taşıma olasılığı yüksek olduğu için çocuğun hem anne hem babadan benzer genleri alma şansı artıyor ve böylece resesiv (çekinik) geçişli hastalıklar bu yüzden akraba evliliğinde artıyor.
Akraba evliliği geleneklerle, inançlarla, toplumsal sorunlarımızla bağlantılı bir gerçeğimiz. Türkiye genelinde %21.5 olan akraba evlilikleri doğu ve güney doğu anadoluda % 50 ye yaklaşır. Amca kızına talip olunduğunda onu red etmek çok ciddi hatta kanlı sonuçlar yaratabilir. Düşünün ki büyük iş adamı Sakıp Sabancı teyze kızı ile evli idi. CHP genel başkanı Kılıçdaroğlu da öyle Yine düşünün lütfen neden Japonyada akraba evliliği binde birin altındadır. Bilim toplumu olmak, bilime öncelik veren bir bilince sahip olmak kolay değil. Şu anı ile bitireyim yazıyı. Dernekte genetik kas hastalıklarını anlattığım bir toplantıda doğaldır ki akraba evliliğinden de söz etmiştim. Bitirince sorular bekledim. Akıllıca sorular alma olasılığının zayıf olduğunu saklayamam. Sorulardan biri “hocam Allahın izin verdiği evlilikten neden zarar gelsin?” idi. Yeterince aydınlanmacı, laik bir eğitimle donatılmamış bir toplumda bilimi geçerli kılmanın kolay olmadığını ve bu konuda politikacılarla, kolayca işbirliği yapma şansımızın olamayacağını vurgulamak istiyorum.
Prof.Dr.Coşkun Özdemir
Kaynak
15 Mart 2015 Pazar
Kök Hücre ile Yapılan Klinik Araştırmalarda Faz Kavramı Üzerine...
Kök hücrelerin kullanıldığı klinik araştırmaların sayısı gün geçtikçe artmakta. Dünyadaki artışa paralel olarak, ülkemizde de az da olsa bir kıpırdanmanın olduğunu izliyoruz. Dolayısıyla bu durum, bir yandan insan kök hücrelerinin veya ürünlerinin kullanımına ilişkin yasal düzenlemelerin de sık sık güncellenmesini gerektirirken öte yandan bu çalışma başvurularının değerlendirileceği etik kurulların ve T.C. Sağlık Bakanlığının ilgili kurum ve komisyonlarının karar verme süreçlerinin de gözden geçirilmesini ve güncelleştirilmesini gerekli kılmaktadır.
Projelerin parasal destek aradığı proje
panellerindeki panelistlerin de bu konuda bilgisinin bulunması zorunluluğu var.
Dünyadaki mevcut araştırma protokolleri bilinmeden/incelenmeden verilen
yüzeysel ve hatalı kararlar ülkemizde kök hücre klinik çalışmalarının önünü
gereksiz yere tıkamakta.
2015 Mart ayı itibariyle kök hücreler ile yapılacak
klinik araştırma başvurularının Klinik Araştırmalar Yerel Etik Kurul’larında
görüşülüp olumlu sonuç aldıktan sonra S.B. Sağlık Hizmetleri Genel Müdürlüğü’ne
bağlı Kök Hücre Nakilleri Bilimsel Danışma Kurulu’nun onayı ve desteği için
başvurması gerekmekte. Eğer sonuç bunda da olumlu olursa klinik araştırmanın
başlaması için yasal izin süreci tamamlanmış olmakta. Dolayısıyla kök hücreyi
konu alan bir klinik araştırma, daha başlamadan önce üç farklı kişi grubunu bir
araya getirmekte;
i) araştırmacılar,
ii) etik kurul üyeleri,
iii) danışma kurulu üyeleri.
Tüm dünyada olduğu gibi ülkemizde de insan üzerinde
yapılan kök hücre araştırmaları oldukça yeni. Bu çalışmalar, bugüne kadar
alışılagelen ilaç, tıbbi cihaz veya biyoeşdeğerlilik araştırmalarına birçok
yönüyle benzememekte. Bu kısa yazıda kök hücre araştırmalarında
uygulanan ve bugüne dek sayıları 5000’i aşmış olan klinik araştırmada (Bkz.
www.clinicaltrials.gov) kullanılan “faz” kavramının kapsamını gözden geçirmeyi
amaçladık.
Tedavi Denemesi:
Genellikle ilaç çalışmalarında kullanılmayan bu uygulama kök hücre çalışmalarında
ilk aşama (Faz 0) değerlendirilebilir. Literatürde yeterli sayıda hayvan
deneyinde (özellikle büyük hayvan türlerinde) olumlu sonuçların alındığı
durumlarda veya genellikle yurt dışı merkezlerde az sayıda hastada uygulama
örnekleri olan bir kök hücre türünün/yönteminin genellikle tek bir olgu
üzerinde denenmesi anlamında kullanılmaktadır. Ancak çoğunlukla
uygulayıcılar (bir hekimin klinik gelişimini takip ettiği hastası için
başvurması) önerdikleri uygulamayı etik kurula ve ardından bakanlığa sunarken o
güne dek mevcut tedavi yöntemlerine rağmen bir iyileşmenin görülmediği
durumlarda ve genellikle hastanın ölümüne yakın dönemde başvurulan bir tedavi
denemesi olarak görmektedirler. Hal böyle olunca, tek bir hasta için uygulanan
bu girişimin yararlı olma olasılığı oldukça düşmekte ve elde edilen sonuçtan
bir bilimsel anlam çıkarmak mümkün olamamaktadır. Bu nedenle, özellikle danışma
kurulu tek tek izin talebinde bulunulan bu hastalar için olgu başına karar vermekle
birlikte giderek yaygınlaşan uygulama talepleri için toplu bir başvuruda
bulunulması yönünde tavsiye kararı vermektedir. Böylece çalışmaya alınacak
olan hasta sayısı arttıkça elde edilen sonuçların istatistiksel olarak anlamlı
olup olmadığı anlaşılacak, bu sayede belli hastalık için bir referans bilgi ve
bir merkez oluşturulmuş olacaktır. Kuşkusuz, bu tür girişimler aşağıda
açıklanan Faz 1-2 tedavi protokollerine uygun olarak hazırlanmalıdır.
Faz 1 Klinik Çalışma: İlaç çalışmaları için tanımlanmış olan faz 1 çalışmalarda güvenlik
ön plandadır, ancak bu aşamada ilacın nasıl emildiği, ne süreyle vücutta
kaldığı, nasıl atıldığı (farmakokinetik ve farmakodinamik) yan ve istenmeyen
etkilerinin (farmakovijilans) neler olduğu gözlenir. Çalışmaya katılanlar
genellikle sağlıklı gönüllülerdir ve sayıları 20-80 arasındadır.
Bu aşama ülkemizde sadece ruhsatlandırılmış merkezlerde belli bir yönergeye
uygun olarak yürütülür ve hastaların sigortalanmasını gerektirir.
Kök hücre çalışmalarında ise de fakto durum bundan
farklıdır. Sağlıklı gönüllülerin kullanıldığı bir kök hücre çalışmasına bugüne
dek pek rastlanmamıştır. Genellikle seçilmiş hastalar kullanılır ve
hasta sayısı 10 civarında tutulur. Embriyonik kök hücre veya uyarılmış
pluripotent kök hücreler gibi tartışmalı olan hücreler için bu sayı 2-4’e
kadar çekilmektedir. İlaç çalışmalarında olduğu gibi kök hücre ile yapılan faz
1 klinik çalışmalarında da güvenlik ilk irdelenen unsurdur.
Bu aşamada etkinlik beklenmez. Düzenlemeler gereğince
hastaların sigortalanması gerekir. Genel eğilim proje masraflarının fonlayıcı
bir kurum (kamu veya özel) tarafından ödenmesi yönündedir. Hastaların tedavi
masraflarını ödemesi gerek tıbbi gerekse yasal nedenle kabul edilmez.
Faz 2 Klinik Çalışma: İlaç çalışmalarında hastalardaki kısa ve orta erimli tedavi
etkinliğinin değerlendirildiği faz 2 çalışmaların bir kısmı plasebo kontrollü
ve tek-çift kör olarak yürütülür.
Genellikle hasta izlem süresi faz 1 çalışmalara göre
daha uzundur. Verilen ilacın etkin olup olmadığı, etkinlik aralığı ve süresi
değerlendirilir. Genellikle faz 2a’da 50-100, faz 2b’de 100-200 hasta yer alır.
Sigorta zorunluluğu vardır ve faz 2 çalışma yapacak merkezin bu amaç için
ruhsatlandırılmış olma zorunluluğu yoktur. Buna karşın kök hücre ile yürütülen
faz 2 çalışmalar, literatür taramasından anlaşılacağı üzere, genellikle 10-50
arasındaki seçilmiş hastanın değerlendirildiği etkinlik çalışmasıdır. Bu
çalışmalarda da güvenlik unsuru irdelenir, mümkün olabildiğince değişkenler
(yaş, cinsiyet vb.) benzer tutulmaya çalışılır. Çoğunlukla faz 1 ve faz 2
çalışmalar birlikte yürütülür (faz 1/2); böylece bir yandan güvenlik diğer
yandan etkinlik değerlendirilir. Hasta sigortalanması zorunludur. Çalışmanın
fonlanması kaçınılmazdır. Literatür değerlendirildiğinde bu tür çalışmaların
yarıya yakın bölümünde kontrol grubu/larının da yer aldığı görülür. Kök hücre
çalışmalarında plasebo grubu pek uygulanmazken bazı çalışmalarda etkinliği
sorgulanan hücre/yöntem bilinen bir tedavi yönteminin yanında verilir. Örneğin
kalpte rejenerasyonun sorgulandığı bir çalışmada tüm hastalara baypas cerrahisi
uygulanırken sadece bir grup hastaya belli hücrelerin de verilmesi gibi.
Faz 3 Klinik Çalışma: Kök hücre çalışmalarında faz 3 çalışma genellikle farklı
merkezlerin katılımıyla gerçekleşen, birkaç yüz hasta üzerinde yapılan
çalışmalardır. Bu çalışmalarda da sigorta zorunluluğu vardır. Ülkemizdeki kök
hücrelere ilişkin bu tür çalışmalar uygulandığı taktirde SGK’nın tedaviyi geri
ödemesi için başvurusu yapılması gündeme gelebilir. Nitekim GVHD hastalarında
(*) geri ödeme uygulaması bu planda
alınmış doğru bir karardır. Sırada periferik arter iskemisinde mezenkimal kök
hücre uygulaması bulunmaktadır. Çünkü, bu hastalarda sözü edilen hücrelerin
etkinliği faz 3 düzeyindeki çalışmalarla kanıtlanmıştır. Bunu diğerleri
izleyecektir.
Görülmektedir
ki, desteklenmek üzere sunulması planlanan, hali hazırda sunulmuş olup onay
bekleyen ve onay alıp yürütülmekte olan kök hücre çalışmalarının
değerlendirilmesinde farklı bir bakış açısına gerek bulunmaktadır. Bu konuda
literatürde yayınlanan seriler ve meta-analizler örnek alınmalıdır. Öte yandan
unutulmamalıdır ki, 2008 yılında tek bir kişide trakea atrezisini tedavi etmek
için kullanılan otolog kemik iliği kök hücrelerinin başarısı bile önemli bir
gelişme olarak lanse edilmişti. Kök hücrelerin hangi koşullarda ilaç olarak
kabul görmesi gerektiği ise bir başka yazının konusu olacaktır.
*
Graft Versus Host Hastalığı: Graft versus host hastalığı (GVHD), bir kök hücre
veya kemik iliği naklinden sonra meydana gelen, yeni aktarılan materyalin organ
alıcısının vücuduna saldırdığı bir komplikasyondur.
Kaynak
Kaynak
Herşeyin Teorisi (Theory of everything) vizyonda
Oscar ödülü En iyi oyuncu ödülünü alan Eddie Redmayne ünlü astrofizikçi, ALS hastası Stephen Hawking'in
hayatını anlatan Herşeyin Teorisi filminde Hawking rolünde oynuyor.
Filmin 2. yarısında Cinemaximum salonlarında ALS MNH DERNEĞİ mizin
tanıtım spotu yayınlanmaktadır Orada da belirtildiği üzere 2576 ya bağışlarınızı bekliyoruz. 1 SMS 1 NEFES Sloganı
ile çıktığımız bu yolda bizi yalnız bırakmadığınız için teşekkür
ederiz. Damlaya damlaya göl oluyor Yapılan bağışlar ALS teşhisi almış,
derneğimize kayıtlı hastalarımıza, akülü tekerlekli sandalye, motorlu
karyola ve pozisyonlu yatak olarak yaşam kalitelerini arttırmak adına
sizlerin katkısını sağlamaktadır. 1 SMS 1 NEFES 2576 Kampanyasına destek
veren Cinemaximum salonlarına teşekkür ederiz
Lyme Hastalığı
Lyme (okunuşu Laym) hastalığı kenelerden geçen bir hastalıktır. Özellikle Amerika'da geyiklerin yoğun olduğu bölgelerde geyik kenelerinden geçtiği bilinen Lyme hastalığı taşıyan kene türünün Türkiye’de görülmediği söylenmektedir. Bunun doğru olup olmadığı bilinmiyor. Lyme hastalığı, bazı kenelerin taşıdığı Borellia burgdorferia bakterisi nedeniyle oluşuyor. Bu bakteriye karşı etkili bir antibiyotik tedavisi uygulanırsa hastalık belirtilerinin düzeldiğini biliyoruz.
Hastalık belirtilerinin ALS- ye benzemesi nedeniyle ALS teşhisi alan ve daha önce kene ısırığı şüphesi olan hastalarda bir süre antibiyotik tedavisi veriliyor. (Özellikle hastalığın başlangıcında, erken döneminde) Bilinen en etkili antibiyotik gurubu ise üçüncü kuşak sefalosporin gurubundan Seftriakson (ceftriaxone) (Rocephin) dir.
Borelia burgdoferia bakterisi, beta laktam halkası olan antibiyotiklere karşı duyarlıdır. Bazı bakteri türleri, beta-laktamaz adlı bir enzim üretirler. Bu durumda beta-laktam içeren antibiyotiklerin etkisi azalır. B-laktam ilacı, bu bakterinin dirençli türlerine karşı, Beta-laktamaz enzimini engelleyerek asıl antibiyotik yanında, etkiyi kuvvetlendirmek için kullanılır.
Bkz : "Endikasyonları: B LAKTAM 1 g IM/IV Enjektabl Toz İçeren Flakon bir beta laktamaz inhibitörü olup belirli antibiyotiklerle kombine edilerek orta ila ağır dereceli bakteriyel enfeksiyonların tedavisinde kullanılır. Kombine antibiyotik kullanımı beta laktam antibiyotiklerinin tek başına uygulanmasına oranla daha yüksek terapötik güvence sağlamasından ötürü, klinik uygulamalarda tercih edilmelidir."
http://www.mn.com.tr/tr/products/p_detail_B-Laktam_.aspx?productID=52
Lyme hastalığında kullanılan Rocephin ilacının üzerinde çeşitli söylentiler olmuştu. Bir gurup biliminsanları ALS + Lyme hastalığı olan vakalar da olabileceğini ileri sürmüştü. Diğer bir gurup ise aslında Rocephine ilacının Nöroprotektif etkisinin olduğunu ileri sürmüştü. Şüpheci bir gurup olan ve ALS de spekülâtif tedavileri araştıran ALS untungled gurubu, Rocephine ilacının üzerinden, üretici firmanın satış taktikleri olabileceğini ve ALS de Rocephine kullanan hastalar üzerinde yapılan araştırmada ilacın etkili olduğunu gösteren bir veriye ulaşamadıklarını rapor etti.
Bkz: http://www.alsuntangled.com/
Çok ender de olsa Lyme hastalığı, ALS belirtilerini taklit edebilir.Aşağıdaki makalede poliradikülopati taklit ettiği ve antibiyotik tedavisi ile belirtilerin düzeldiği bildiriliyor.
http://www.ncbi.nlm.nih.gov/pubmed/24397499
LYME HASTALIĞI NASIL TEŞHİS EDİLİR?
Ne yazık ki Lyme hastalığının yüzde yüz güvenli bir teşhis yöntemi yoktur. Bazı testler yapılıyor olsa da bunlar her zaman doğru sonucu vermemektedir.
Hastada erythema migrans oluşumu varsa, başka belirtiler veya test sonuçları beklenmeden hemen tedaviye başlanması gerekir.
Lyme hastalığı tanısında kullanılan laboratuvar testlerde bazı sorunlar vardır. Bu nedenle tanı koyulmasında klinik bulgular önemli olmaktadır.
Eritema migrans varlığında sadece bu bulgu ile tanı konulabilir
Serolijik testler standartize değildir.
Sıklıkla yanlış negatif ve yanlış pozitif sonuçlar alınabilmektedir.
Test sonuçları mutlaka hastanın öyküsü ve klinik bulgular eşliğinde yorumlanmalıdır.
Test:
1. aşama: ELISA veya IFA ile
2. aşama: Western blot
IFA veya ELISA ile pozitif veya şüpheli çıkan sonuçların daha özgül bir test olan westernblot
ile test edilmesi gerekmektedir.
Lyme'ın teşhisi ile ilgili asıl sorun bazı hastalarda devamlı negatif test sonuçları alınmasına rağmen hastalığın var olmasıdır.
Kenenin ısırdığı yerde başlayan kırmızı yuvarlak bir döküntü olarak başlar. Vücuda yayılabilir. 1 ay içinde kızarıklık geçer. ALS hastaları, Lyme testi sonuçlarına bakılmaksızın antibiyotik tedavisi denemektedir.
Sonuç:
ALS teşhisi alan hastalarda Lyme testi Negatif çıksa bile Lyme hastalığı ihtimaline karşı uygun bir antibiyotik kullanmakta fayda var. Lyme hastalığı erkenden yakalanırsa (ilk 1-2 ay) normalde 1 ay antibiyotik tedavisi ile iyileşiyor. Kronik döneme giren Lyme hastalığının tedavisi çok zor.
Lyme Hastalığı konusunda Türkçe blog: http://lymetr.blogspot.com/
Sağlık bakanlığı çalışması:
Lyme Hastalığı konusunda Türkçe blog: http://lymetr.blogspot.com/
Sağlık bakanlığı çalışması:
Lyme Belgesel
6 Mart 2015 Cuma
ClinicalTrials.gov Hakkında
ClinicalTrials.gov doktorlar,
araştırmacılar, fon sağlayıcılar, kanun yapıcılar ve hatta hastalar için
tonlarca bilgi içeren küresel ölçekli bir web sitesi. Gereksinim duyduğunuz
özel bilgiyi bulan, basit ama güçlü bir arama motoru. Yürütülen binlerce klinik
çalışma içinde kök hücrelerle yürütülen 4745 klinik çalışmayı da içeriyor.
Klinik
araştırmaların ve ilaç geliştirmelerin heyecan verici dünyasında ClinicalTrials.gov
gelişmeleri öğrenmenin en
pratik yollarından birisi olarak kendini gösteriyor ve bu baş döndürücü alanı
bir nebze temsil ediyor. Araştırmacıların ve hastaların sisteme kayıt ve giriş
yapabildiği, serbest erişimli bu internet sitesinin sürdürülebilirliğini
Amerikan Ulusal Sağlık Enstitüsü (NIH) ve buna bağlı Ulusal Sağlık Kütüphanesi
(NLM) sağlıyor. Klinik raporlama alanında bir uzman olan Dr. Deborah Zarin bu
sitenin başkanı. Kendisiyle bir kök hücre uzmanı olan Dr. Paul Knoepfler’in
yapmış olduğu röportajdan bazı alıntılar sunuyoruz.
ClinicalTrials.gov’un
amacı ve misyonu nedir?
ClinicalTrials.gov ABD
ve dünya çapında yürütülen yaklaşık 175.000 kayıtlı girişimsel ve gözlemsel
klinik araştırma çalışması hakkında kamuya kapsamlı bilgi sağlıyor. Bunların
arasında, çoğu daha önce başka bir yerde yayınlanmayan yaklaşık 14.400 kaydın
özet sonucundan oluşuyor. ClinicalTrials.gov dünya üzerinde halka açık en büyük kayıt ve sonuç veritabanı ve
ayda 112 milyondan fazla sayfa görüntülemeye ve günlük 57.000 farklı
ziyaretçiye hizmet veriyor (http://ClinicalTrials.gov/ ct2/resources/trends).
Araştırmacılar ve sponsorlar verilerini ClinicalTrials.gov’a web tabanlı bir protokol kayıt ve
sonuç sistemi üzerinden gönderiyor.
ClinicalTrials.gov 2000
yılında Ulusal Sağlık Kütüphanesi (NLM) tarafından 1997’nin Gıda ve İlaç
Dairesi (FDA) Modernizasyon Yasası’na karşılık olarak ve NLM’nin biyomedikal
bilgiyi yayma ve kamu sağlığını geliştirme görevini desteklemek için kuruldu. O
zamandan bugüne, ClinicalTrials.gov önemli oranda büyüdü ve ileriye dönük kayıtları tutan
International Committee of Medical Journal Editors (ICMJE) gibi oluşumları da
destekler oldu. 2007 yılında Gıda ve İlaç Dairesi Yasasının 801. maddesinde
(FDAAA 801) yapılan değişiklikle bir önceki yasadaki zorunlu kayıt koşulunu faz
1 olmayan ve FDA tarafından kontrol edilen ilaçlar, biyolojik ürünler ve
cihazlarla yapılan çalışmaları; ve her çalışmaya ait ek bilgileri kapsayacak
şekilde genişletti. Bu değişiklik ayrıca sonuçların bildirildiği veritabanının
oluşturulmasını da sağladı.
ClinicalTrials.gov
kullanımının sürekli
artışı, kayıt ve sonuçları raporlamanın bilimsel ve etik öneminin tüm dünyada
anlaşılmasının yanı sıra ABD federal yasası sayesinde olmuştur. Birleştirilmiş
kayıt ve sonuçlarını barındıran bu veritabanı, hastalar, sağlık alanındaki
uzmanlar, sağlık sigortası sunan kuruluşlar ve politik karar mercileri için
devam eden ve tamamlanmış klinik çalışmalara ilişkin kritik bilgiye erişim
sağlıyor. Örneğin, çalışmanın potansiyel katılımcıları, klinik tedavi uzmanları
ve araştırmacılar ilgilendikleri çalışmaları buradan bulabilir, devam eden
çalışmaların özet protokollerine, hasta kabul bilgilerine ve tamamlanmış
çalışmaların sonuçlarına buradan ulaşabiliyorlar. Bilimsel yayın editörleri,
bilimsel makale değerlendirme hakemleri ve okuyucular ClinicalTrials.gov’u önceden belirlenmiş değerlendirme
ölçütlerini incelemek için kullanabilir ve dergilere başvurusu yapılan metinler
ve yayınlarda ifade edilmeyen değişiklikler için özet protokol bilgisini gözden
geçirebilirler. Yayınlanmak üzere gönderilen makale hakemleri yayınlanmamış
çalışmaları ve sonuçları arayıp bulabilirler. ClinicalTrials.gov beklenmeyen sonuçların da izlenebildiği bir platform haline
gelmiştir.
Araştırma ekibinin sorumlusu tarafından
ClinicalTrials.gov’a girilmesi gereken
belli çalışmalar var mı?
ABD’de
konuyla ilgili iki zorunluluk FDAAA 801 ve International Committee of Medical
Journal Editors (ICMJE) çalışma kaydı politikasıdır. Bir ABD federal yasası
olan FDAAA 801, çalışma sponsorunun veya onun başındaki araştırmacının
kaydolması ve FDA’nın kontrolündeki ilaç veya cihazların faz 1 dışındaki
girişimsel çalışmalarının sonuçlarını rapor etmesi gibi bir yasal zorunluluk
içerir. Buna uymamanın azımsanmayacak bir cezası vardır. Hükümler 2007 yılından
başlayarak yürürlüğe girse de, bu kanun için düzenleyici işlemler hali hazırda
devam etmektedir. ICMJE politikası ise fazına veya girişim türüne bakmaksızın
her girişimsel çalışmanın kaydını gerektiriyor; buna uymamanın cezası ise bilimsel
bir derginin burada kaydı olmayan bir çalışmayı yayınlamak üzere dikkate
almayacak olması. Diğer önemli uluslararası kayıt kanunları ve politikalarıysa
şu adreste belirtiliyor; http://ClinicalTrials.gov/ct2/manage-recs/background#WhyRegister.
ClinicalTrials.gov’da yer alması sakıncalı belli
çalışmalar var mı? Eğer varsa, sebebi nedir?
ClinicalTrials.gov
dünyanın her yerindeki
çalışma sponsorlarına ve araştırmacılara ait bilgiyi kabul ediyor. Tek koşul,
bu çalışmanın insan denekler içermesi ve geçerli kanun ve yönetmeliklere uygun
olması (örneğin etik kurullardan geçmiş olması).
Yasal, düzenleyici ve etik değerlendirmelerden
bize biraz daha söz eder misiniz?
Biz
araştırıcılardan spesifik olarak IRB (kurumsal etik değerlendirme komisyonu
raporu) bilgisini talep ediyoruz. Web sayfamızdaki “seçenekler” menüsünde
“beklemede”, “onaylandı” ve“muaf” gibi seçenekler bulunuyor. Çalışmaların IRB
onayı aldığını bildirmeden “hasta topluyor” veya “açık” olarak ifade edilmesine
izin vermiyoruz. En az bir IRB mektubunun kopyasını istiyoruz ama bunun için
zorlamıyoruz. Yasal ve mevzuata ilişkin başka hususları araştırmıyoruz; bu
sorumlu tarafın bize “belgelendirmesi” gereken bir şey. Biz gözetim
otoritelerinin olduğu bir liste sunuyoruz, eğer çalışmayla ilgili gözden
kaçırılan bir problem varsa sayfaya girenler ve biz bu konuda bilgilenmiş
oluyoruz. Bu durum özellikle ABD dışından kayıt yaptıran ve lokal düzenleyici
sistem hakkında pek bir şey bilemediğimiz çalışmalar için geçerli.
Hangi araştırmacılar ClinicalTrials.gov’a
klinik deneme girişinde bulunabiliyor? ClinicalTrials.
gov ekibi çalışmanın internet sitesinde yer almasına izin verip
vermemeye nasıl karar veriyor? Ne tür bir güvenlik incelemesi yapılıyor? Onur
sistemi diye bir şey var mı?
ClinicalTrials.gov
ABD federal hükümeti,
ilaç ve tıbbi cihaz firmaları, akademik ve uluslararası kuruluşlar dahil olmak
üzere yaklaşık 12.500 çalışma grubu tarafından gönderilen klinik çalışma
bilgisini bünyesinde bulunduruyor. Başvuru gönderildikten ve bir personel
tarafından gözden geçirildikten sonra ClinicalTrials.gov her kuruluş (örn. şirket, üniversite veya tıp merkezi) için web
tabanlı bir PRS hesabı oluşturuyor. Bir kuruluşta çalışmayı yürüten tüm
araştırmacılar bu tek PRS hesabı içinde kullanıcı olarak atanıyorlar. Kuruluşlar
genelde hesabı yönetmek ve diğer kullanıcılara giriş oluşturmak için bir veya
daha fazla kişiyi PRS yöneticisi olarak belirliyor. Sunulan her veri iki
aşamalı bir süreçten geçiyor; (1) otomatik doğrulama sistemi gerekli veri
elemanları için eksik ve geçersiz veriyi belirliyor (ör. sayısal veri
gerektiğinde karakter girilmesi gibi); (2) elle yapılan inceleme süreci
belirgin geçerliliğe, anlamlı girdilere, mantığa, kendi içinde tutarlılığa ve
biçimlemeye odaklanıyor. Sunulan bilginin dışsal geçerliliğini
değerlendirmiyoruz çünkü onaylanmış bir referans standardımız yok.
ClinicalTrials.gov’un
kâr amacı güden çalışmalarla ilgili özel bir politikası var mı? Resmi bir
politikası yoksa bu konuya bakış açınızdan söz eder misiniz?
ClinicalTrials.gov’un kâr amacı güden çalışmalarla
ilgili bir özel politikası yok. Kayıt ve sonuçları raporlamayı, geçerli kanun
ve yönetmeliklere uygun olan tüm klinik çalışmalar için finansman kaynağına ve
diğer özelliklerine bakmaksızın kayıt yapılmasını teşvik ediyoruz. Daha önce
söz ettiğim gibi, etik ve bilimsel sebeplerden dolayı, şeffaflığın insanda
yapılan tüm biyomedikal veya sağlıkla ilgili araştırma çalışmalarında önemli
olduğuna kuvvetle inanıyoruz. Bunun için http://ClinicalTrials.gov/ct2/manage-recs/background sayfasındaki bilgi faydalı olabilir.
Klinik
raporlama alanında bir uzman olan Dr. Deborah Zarin bu sitenin başkanı.
Kendisiyle bir kök hücre uzmanı olan Dr. Paul Knoepfler’in yapmış olduğu
röportajın devamını sunuyoruz.
ClinicalTrials.gov’un
kâr amacı güden çalışmalarla ilgili özel bir politikası var mı? Resmi bir
politikası yoksa bu konuya bakış açınızdan söz eder misiniz?
ClinicalTrials.gov’un
kâr amacı güden çalışmalarla ilgili bir özel politikası yok. Kayıt ve
sonuçları raporlamayı, geçerli kanun ve yönetmeliklere uygun olan tüm klinik
çalışmalar için finansman kaynağına ve diğer özelliklerine bakmaksızın kayıt
yapılmasını teşvik ediyoruz. Daha önce söz ettiğim gibi, etik ve bilimsel
sebeplerden dolayı, şeffaflığın insanda yapılan tüm biyomedikal veya sağlıkla
ilgili araştırma çalışmalarında önemli olduğuna kuvvetle inanıyoruz. Bunun için
http://ClinicalTrials.gov/ct2/ manage-recs/background sayfasındaki bilgi faydalı
olabilir.
Her bilimsel girişimde olduğu gibi,
klinik araştırmalar da araştırmacılar, katılımcılar, fon sağlayıcılar,
düzenleyiciler, yayın hakemleri dahil olmak üzere pek çok önemli paydaşı
kapsayan geniş bir “eko sistem” içinde yürütülür. Böyle olunca da, belirli bir
çalışmanın veya tasarımın olası bilimsel ve etik katkıları bütün çevre göz
önüne alınarak değerlendirilmelidir. Örneğin, çalışılan konu, sorulan bilimsel
soru hakkında ne biliniyor? Bu konuyla ilişkili hangi çalışmalar yapılmış ve
sonuçları nelerdir? Konuyla ilgili hali hazırda hangi çalışmalar yapılıyor?
Biz ClinicalTrias.gov’u insanların bu tür soruları çalışma
başlamadan yanıtlamasına yardım eden bir araç olarak görüyoruz. Klinik
araştırma kuruluşunun bilgilendirilmesi ve kanıta dayalı tıbbın geliştirilmesi
için, bir çalışmanın planlanınca, kaydedilmesi gerektiğine, tamamlandıktan
sonra ise özet sonuçların rapor edilmesi gerektiğine inanıyoruz.
Ben ClinicalTrials.gov’da
yer alan bazı çalışmalar için endişe duyuyorum. Bana göre bunlar daha çok kâr
etme peşinde olup hastalara yardımla ve veri oluşturmayla daha az ilgileniyor
olabilirler. Genel olarak gelecekte ClinicalTrials.gov’un
sunulan çalışmaların güvenlik incelemesini daha fazla yapması mümkün mü?
Paydaşların belli çalışmalardan endişe duyduklarında endişelerini ClinicalTrials.gov
ekibine iletebilecekleri bir mekanizma var mı?
ClinicalTrials.gov
klinik araştırma
çalışmalarının kalitesini değerlendiremez, bu fon sağlayıcıların,
düzenleyicilerin ve etik inceleme kurullarının görevidir. ClinicalTrials.gov’un rolü klinik çalışmalar
hakkındaki bilginin kamu tarafından ulaşılabilir olmasını sağlamak ve
dolayısıyla başkalarının da bu verileri analiz etmesine imkan vermektir. Bu,
farklı alanlarda bilgi sahibi olan paydaşların ClinicalTrials.gov’a konan bilginin kalitesini değerlendirmesini sağlar. Bir
benzetme yapmak gerekirse PubMed, kamunun, hakemli biyomedikal dergilerde
yayınlanan makaleler hakkında bibliyografik bilgiye erişimini sağlar.
Yayınevleri, bilimsel yayın editörleri ve bilimsel makale değerlendirme
hakemleri yayınlanma öncesinde metnin dikkatle incelenmesinden sorumludurlar.
Ancak başka araştırmacılar da yayınlanan makalelerin kritiğini yapabilir, bu
bilimi daha da geliştirir.
Çoğunlukla ClinicalTrials.gov’a girilen bir kayıttaki hatayı
tespit eden paydaşlarımızdan ilgili kuruluşla veya bilgiyi sunan kişiyle
iletişime geçmesini istiyoruz. Hukuki sorunlar ortaya çıktığında
paydaşlarımızın çalışma üzerinde yargı yetkisi olan düzenleyici kuruluşla veya
gözetim organıyla irtibata geçmelidirler.
Hali hazırda ClinicalTrials.gov
çalışmalar hakkında elde ettiği bütün bilgiyi vermiyor. Gelecekte
belli konularda endişesi olan paydaşların web sitesinin yürüttüğü politikalar
hakkındaki görüşlerinin yer alabileceği veya hastaların ödemesi gereken
ücretler gibi daha çok bilgiye yer vermek ve benzerleri gibi önerilerde
bulunabildikleri bir mekanizma olabilir mi?
HHS (Health
and Human Services) CilinicalTrials.gov raporlaması için yakında FDAAA
koşullarıyla ilgili Notice of Proposed Rulemaking (NPRM) yayınlayacak.
Üzerinde halkın yorum yapabilmesi için yayınlanan bilgi 90 gün askıda kalacak.
Dolayısıyla bu sorunların birçoğu gözden geçirilmiş olacak (hangi bilgi kayda
geçirilmeli, hangi bilgi halka açık olmalı gibi). NPRM’de yayınlananlar
hakkında bilgilenmek istiyorsanız, FDAAA-UPDATE-L’e abone olmalısınız
(https://list.nih.gov/cgi-bin/ wa.exe?SUBED1=fdaaa-update-l&A=1.
Gelecek için
vizyonunuz nedir?
Gidişatımıza
göre siteyi daha da ileriye götürecek yenilikler planlıyoruz. Örneğin;
yayınlanan veriler bilimsel alanda yeni çalışmaları doğru bir şekilde temsil
edeceği şekilde sürekli olarak yapılandırılmalıdır. Örneğin; yeni bilim
alanları ortaya çıktıkça sitedeki yapılandırılmış verilerin yeni kayıtlara ve
arama yöntemlerine uygun hâle getirilmesi gerekir. “Kök hücre çalışmalarını
nasıl sınıflandırmalıyız?” ve “Ödemenin dahil olup olmadığı hakkında bilgi
sunulmasını talep etmeli miyiz?” gibi sorular sorulabilir.
ClinicalTrials.gov
çalışmada yer alan
önemli paydaşlara çalışma metodolojisiyle ilgili sorunları izleyip
değerlendirmelerini sağlayan bir araç sağlamaktadır. Bunun nihai değeri
insanların kullanım şekillerine dayanmaktadır. Bu durum klinik araştırmaları
etkileyen ilgili kanunlardan, politikalardan ve teşvik edici yapılardan büyük
oranda etkilenmektedir. Bu sebeple, en büyük değişikliklerden birisi,
insanların ClinicalTrials.gov’u kullanma şekillerini etkileyecek
olan politikaların düzenlenmesi olacaktır.
Kaydol:
Kayıtlar (Atom)







